随着海关总署不断深化“放管服”改革,持续优化口岸营商环境,目前我国进出口环节监管证件精简至41种,除部分特殊情况外,已实现联网核查38种。
其中,涉及到药品进出口的监管证件有《进口药品通关单》《麻精药品进出口准许证》《药品进口准许证》《药品出口准许证》,均由国家药品监督管理局及其授权发证机关签发,由海关负责口岸验核。
进口药品通关单管理是指国家药品监督管理局及其授权发证机关依据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品进口管理办法》等法律法规及规章,对纳入《进口药品目录》管理的进口药品签发进口药品通关单,海关依法对进口药品实施监管。
进口单位凭《进口药品通关单》向海关申报,并按规定办理通关手续。《进口药品目录》详见原国家食品药品监督管理局 海关总署公告 2011年第104号。
提示:进口药品应办理进口备案(即申办《进口药品通关单》的过程)。进口药品必须取得国家药品监督管理部门核发的《进口药品注册证》(或者《医药产品注册证》),或者《进口药品批件》后,方可办理进口备案和口岸检验手续。
进口麻醉药品、精神药品,还必须取得国家药品监督管理部门核发的麻醉药品、精神药品《进口准许证》。
根据《药品进口管理办法》(原卫生部 海关总署第86号令),进口单位向允许药品进口的口岸所在地药品监督管理部门(以下称口岸药品监督管理局)申请办理《进口药品通关单》的过程称进口备案。
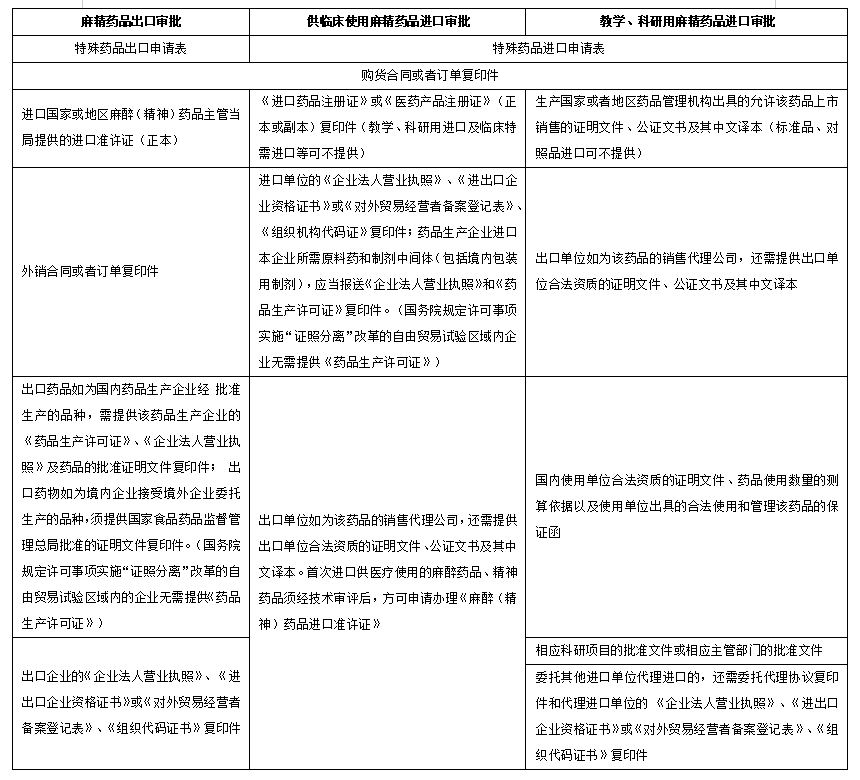
办理进口备案,报验单位应当填写《进口药品报验单》,持《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)原件,进口麻醉药品、精神药品还应当持麻醉药品、精神药品《进口准许证》原件,向所在地口岸药品监督管理局报送所进口品种的有关资料一式两份:
1.《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)复印件;麻醉药品、精神药品的《进口准许证》复印件。
2.报验单位的《药品经营许可证》和《企业法人营业执照》复印件。
3.原产地证明复印件。
4.购货合同复印件。
5.装箱单、提运单和货运发票复印件。
6.出厂检验报告书复印件。
7.药品说明书及包装、标签的式样(原料药和制剂中间体除外)。
8.国家药品监督管理局规定批签发的生物制品,需要提供生产检定记录摘要及生产国或者地区药品管理机构出具的批签发证明原件。
9.国家药品监督管理局规定批的生物制品、首次在中国境内销售的药品和国务院规定的其他药品以外的药品,应当提交最近一次《进口药品检验报告书》和《进口药品通关单》复印件。
药品生产企业自行进口本企业生产所需原料药和制剂中间体的进口备案,第2项资料应当提交其《药品生产许可证》和《企业法人营业执照》复印件。
经其他国家或者地区转口的进口药品,需要同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票等。
上述各类复印件应当加盖进口单位公章。
麻精药品包含麻醉药品和精神药品。麻醉药品是指连续使用后易产生身体依赖性、能成瘾癖的药品。精神药品是指直接作用于中枢神经系统,使之兴奋或抑制,连续使用可产生依赖性的药品。依据精神药品使人体产生的依赖性和危害人体健康的程度,精神药品分为第一类精神药品和第二类精神药品。国家药品监督管理部门依法对上述药品实施进出口监督管理,签发准予进出的许可证件。包括《麻醉药品进出口准许证》《精神药品进出口准许证》。
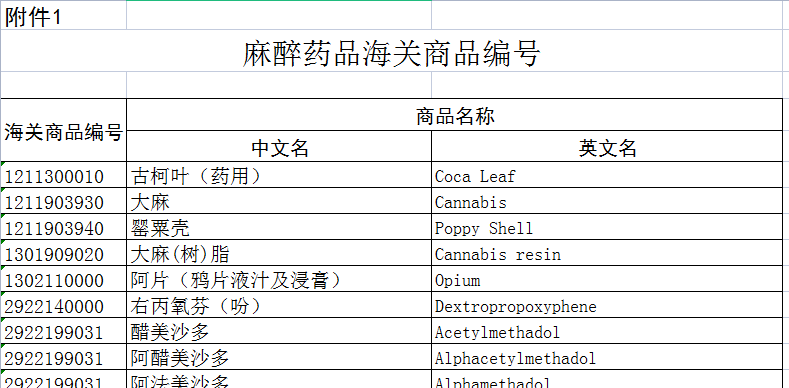
纳入《麻醉药品管制品种目录》范围的麻醉药品及纳入《精神药品管制品种目录》范围的精神药品。详见《原国家食品药品监督管理总局 海关总署关于麻醉药品和精神药品海关商品编号的公告》(2013年第54号)和《国家药监局 海关总署关于瑞马唑仑海关商品编号的公告》(2020年第39号)。
《原国家食品药品监督管理总局 海关总署关于麻醉药品和精神药品海关商品编号的公告》(2013年第54号):
《国家药监局 海关总署关于瑞马唑仑海关商品编号的公告》(2020年第39号):
具体申请材料详见《国家药监局关于发布麻醉药品和精神药品进出口准许证申报资料要求的通告》(2021年第90号)或国家药监局官网办事指南。
药品进出口准许证管理是指国家药品监督管理局及其授权发证机关依据《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《反兴奋剂条例》《蛋白同化制剂和肽类激素进出口管理办法》等法律法规及规章,依法对列入兴奋剂目录的蛋白同化制剂、肽类激素等供医疗使用及教学、科研需要的兴奋剂实施进出口准许证管理,签发准予进出口的许可证件,海关依法对进出口蛋白同化制剂、肽类激素实施监管。
今年进出口管理的蛋白同化制剂、肽类激素品种详见《2022年兴奋剂目录公告》(国家体育总局、商务部、国家卫生健康委员会、海关总署、国家药品监督管理局公告2021年第56号)
详见《蛋白同化制剂和肽类激素进出口管理办法》(原国家食品药品监督管理总局令第37号)
企业依流程取得相关证件后,在进出口申报时,按要求将相关证件信息填报到中国国际贸易“单一窗口”直接申报即可。“单一窗口”系统自动比对证件信息,如发现申报信息与证件填报要求不符,系统将提示比对不通过。
1.药品必须经由国务院批准的允许药品进口的口岸进口,进口药品的口岸必须与监管证件核准的口岸一致。批准进口口岸具体如下:
(1)进口药品(包括麻醉药品、精神药品、蛋白同化制剂、肽类激素)口岸::北京市、天津市、上海市、大连市、青岛市、成都市、武汉市、重庆市、厦门市、南京市、杭州市、宁波市、福州市、广州市、深圳市、珠海市、海口市、西安市、南宁市等19个城市所在地直属海关所辖关区口岸以及苏州工业园区口岸、济南航空口岸、长沙航空口岸、郑州航空港口岸、沈阳航空口岸、无锡航空口岸、江阴港口岸、长春空港口岸、中山市中山港口岸。
(2)中药材进口口岸:黑龙江省黑河、东宁,吉林省集安、长白、图们、三合,内蒙古自治区二连浩特、满洲里,广西壮族自治区凭祥、东兴、龙邦,云南省瑞丽、天保、景洪、河口,新疆维吾尔自治区阿拉山口、霍尔果斯、吐尔尕特、红其拉甫,西藏自治区樟木、吉隆、普兰等共22个边境口岸以及北京市、天津市、大连市、上海市、南京市、杭州市、宁波市、福州市、厦门市、青岛市、武汉市、广州市、深圳市、珠海市、海口市、重庆市、成都市、西安市、南宁市等19个市行政区域内口岸。
(3)生物制品(疫苗类、血液制品类及血源筛查用诊断试剂等)进口口岸限定为北京市、上海市、广州市、重庆市和成都市5个口岸;首次在中国境内销售的药品进口口岸限定为北京市、上海市、广州市、重庆市4个口岸。
2. 进出口药品申报时需在报关单“随附单据”代码栏填报监管证件代码,在编号栏填报证件编号。监管证件代码分别是《进口药品通关单》为“Q”,《麻醉药品精神药品进出口准许证》为“I”,《药品进出口准许证》为“L”。
3.药品《进口准许证》有效期1年。药品《出口准许证》有效期不超过3个月(有效期时限不跨年度)。
4.《进口药品通关单》《麻醉药品精神药物进出口准许证》实行“一批一证”管理,证面内容不得更改,如需更改,须换发新证。《药品进出口准许证》实行“一证一关”管理,只能在有效期内一次性使用,证面内容不得更改。
5.海关特殊监管区域和保税监管场所与境外进出及海关特殊监管区域、保税监管场所之间进出的药品的,免予办理进出口药品监管证件,由海关实施监管。从海关特殊监管区域和保税监管场所进入境内区外或从境内区外进入海关特殊监管区域和保税监管场所的应当办理进出口药品监管证件。